|
|
RAPORT Z BADAŃ REALIZOWANYCH W PROJEKCIE W PIERWSZYM PÓŁROCZU
Raport z badań realizowanych w projekcie w pierwszym półroczu 2010 r.
1. Zakup aparatury i szkolenie pracowników.
W pierwszym kwartale 2010 r. z funduszy projektu zakupiono aparaturę, która będzie wykorzystywana do realizacji zaplanowanych badań. Między innymi kupiono inkubatory do hodowli Trichoderma, komory klimatyczne do prowadzenia biotestów, autoklawy, suszarki sublimacyjne do liofilizacji grzybni Trichoderma, wirówki, wstrząsarki. Kupiono również spektrofotometry do wykonywania oznaczeń biochemicznych aktywności enzymatycznej grzybów Trichoderma lub określania koncentracji związków wskazujących na reakcje odpornościowe, wzbudzane w roślinach po ich inokulacji tymi grzybami. Natomiast spektrofotometr Nano Drop będzie wykorzystywany do pomiaru stężenia i czystości kwasów nukleinowych wyizolowanych z Trichoderma. Wszystkie urządzenia umieszczono w zaplanowanych dla nich pomieszczeniach, a pracownicy zostali przeszkoleni przez specjalistów w zakresie obsługi i konserwacji nowej aparatury.
Fot. 1. Aparatura zakupiona dla projektu.
2. Realizacja zadania badawczego ZB3 pt. „Typowanie szczepów Trichoderma o określonych właściwościach biologicznych do produkcji biomasy i zastosowania w integrowanej produkcji warzyw”
W pierwszym półroczu przeprowadzono wstępne serie testów zaplanowanych w systemie selekcji grzybów Trichoderma AMOR. Do testów wykorzystano izolaty Trichoderma z gatunków T. harzianum, T. atroviride oraz T. virens znajdujące się w kolekcji Pracowni Mikrobiologii Instytutu Warzywnictwa oraz przesłane przez Partnerów z Uniwersytetu Przyrodniczego we Wrocławiu. W trakcie realizacji zadań prowadzono również ekspedycje do gospodarstw ekologicznych, gdzie pobierano próby gleby oraz kompostów do izolacji nowych szczepów Trichoderma.
Fot. 2. Izolacja grzybów Trichoderma z prób gleby.
Zdolności antagonistyczne Trichoderma.
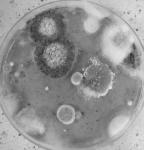
W testach laboratoryjnych badano zdolność różnych izolatów Trichoderma do ograniczania wzrostu oraz pasożytowania grzybni patogenów z rodzaju Fusarium, Pythium oraz Rhizoctonia solani, Botrytis cinerea, Sclerotinia sclerotiorum i Sclerotium cepivorum. Stwierdzono, że grzyby Trichoderma najsilniej hamowały rozwój Pythium, S. sclerotiorum, S. cepivorum i R. solani. Najbardziej oporne na ich antagonistyczne działanie były grzyby z rodzaju Fusarium. Jednak niektóre izolaty Trichoderma silnie zarastały kolonie Fusarium produkując przy tym intensywnie zarodniki konidialne (fot. 3). Do chwili obecnej w teście dyfuzyjnym przebadano 78 izolatów Trichoderma, z czego 9 szczepów wykazywało silne właściwości antagonistyczne.
Fot. 3. Antagonizm Trichoderma wobec grzybów patogenicznych w testach dyfuzyjnych.
Produkcja toksycznych związków lotnych przez Trichoderma.
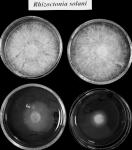
Test wykonano na szalkach z pożywką PDA. Na jednej z szalek wyszczepiono grzyb Trichoderma, na drugiej grzyb patogeniczny R. solani lub Fusarium. Z obu szalek usunięto wieczka, a spody z wszczepionymi na pożywce grzybami połączono parafilmem tworząc szczelną komorę (fot. 4). Ten układ umieszczono w temp. 25 oC (szalka z Trichoderma na dole). Po 48 i 72 godzinach inkubacji wykonywano pomiary średnicy grzybni patogenów w odniesieniu do grzybni kontrolnych.
Przebadano ponad 70 izolatów Trichoderma, z których ok. 18% wykazywało zdolności do silnego hamowania wzrostu grzybni testowych patogenów. Głównie były to izolaty z gatunku T. atroviride. Nieco mniej aktywne pod względem produkcji toksycznych związków lotnych były izolaty T. harzianum. Zdolności tych nie stwierdzono u przebadanych dotychczas szczepów T. virens.
Fot. 4. Działanie toksycznych związków lotnych produkowanych przez Trichoderma. A – sposób prowadzenia testu, B – efekt toksycznych związków lotnych na wzrost R. solani (na górze grzybnia kontrolna R. solani, na dole grzybnia poddana działaniu związków lotnych produkowanych przez Trichoderma
Właściwości mikopasożytnicze Trichoderma.
Aby ocenić zdolności grzybów z rodzaju Trichoderma do pasożytowania mikroorganizmów patogenicznych w uprawach warzyw, rozpoczęto badania mające na celu stwierdzenie obecności w wytypowanych izolatach genów odpowiedzialnych za produkcję enzymów litycznych. Identyfikacja tych genów ułatwi określenie mechanizmu mikopasożytnictwa Trichoderma, a także pozwoli na zaprojektowanie markerów molekularnych, dzięki którym będzie można odróżnić badane izolaty. Badania są prowadzone przy użyciu standardowych metod PCR. W pierwszym półroczu prowadzono optymalizację izolacji DNA z grzybni Trichoderma pochodzących z kultur na pożywkach agarowych, z kultur płynnych prowadzonych w systemie stacjonarnym oraz wstrząsanych. Stwierdzono, że izolacja grzybni namnażanej we wstrząsanej kulturze płynnej daje najlepszy materiał wyjściowy, a ucieranie grzybni w ciekłym azocie z piaskiem kwarcowym pozwala na uzyskanie lepszej wydajności izolacji DNA. Prowadzono optymalizację warunków PCR dla dziewięciu par starterów specyficznych dla genów kodujących enzymy lityczne. Uzyskano sekwencję DNA glukanazy dla izolatu T. atroviride PGU11 przy użyciu starterów glucF/glucR. Sekwencję glukanazy złożono w kontig i porównano ją z sekwencjami dostępnymi w bazie NCBI oraz Trich O’Key. Wykonano PCR z tymi starterami dla wszystkich posiadanych matryc DNA w celu sprawdzenia specyficzności starterów. Ustalono, że startery glucF/glucR dają produkt PCR ze wszystkimi analizowanymi izolatami Trichoderma.
W Katedrze Mikrobiologii i Biotechnologii Żywności Uniwersytetu Przyrodniczego we Wrocławiu badano efektywność produkcji enzymów litycznych przez wytypowane do testów grzyby Trichoderma. Przeprowadzono hodowle wstrząsane w celu oceny uzdolnień Trichoderma do produkcji pozakomórkowych β-1.3-glukanaz, chitynaz oraz proteaz, czyli enzymów odgrywających ważną rolę w biologicznej ochronie roślin przez aktywne mikroorganizmy. W hodowlach stosowano podłoża z dodatkiem biomasy grzybni patogenów jako induktora biosyntezy enzymów litycznych. Aktywność enzymatyczną określano w 3, 5 i 7 dniu hodowli. Aktywność β-1.3-glukanaz lub chitynaz wyrażano w μmolach glukozy uwolnionej z laminaryny lub glukozoaminy z chityny. Aktywność proteolityczną oceniano wobec kazeiny.
Wśród sześćdziesięciu przebadanych izolatów Trichoderma zaobserwowano zróżnicowanie w dynamice biosyntezy wybranych enzymów. U większości izolatów maksymalną aktywność β-1.3-glukanazy uzyskiwano po 7 dniach hodowli. Natomiast chitynazy wykazywały aktywność już po trzech dniach. Stwierdzono najwyższy poziom aktywności β-1.3-glukanaz. Ok. 32% badanych izolatów miało znaczące zdolności do produkcji enzymów z tej grupy. Aktywność chitynaz i proteaz była na niższym poziomie i w obu przypadkach jedynie ok. 18% szczepów wykazywało zdolność do wytwarzania tych enzymów.
W testach prowadzonych w warunkach szklarniowych badano również zdolność Trichoderma do pasożytowania form przetrwalnych takich grzybów jak S. sclerotiorum i S. cepivorum. Nylonowe woreczki zawierające sklerocja patogenów były zakopywane w doniczkach wypełnionych wysterylizowaną ziemią zmieszaną z zarodnikami badanych izolatów Trichoderma. Po miesiącu inkubacji oceniano liczbę odzyskanych z ziemi sklerocjów oraz ich zdolność do wytwarzania grzybni na pożywce agarowej. Okazało się, że wiele z testowanych szczepów powodowało rozpad sklerocjów S. sclerotiorum w glebie. Natomiast te przetrwalniki, które odzyskano były zazwyczaj przerośnięte strzępkami Trichoderma (fot. 4). Wyniki te wskazują na poważne możliwości wykorzystania Trichoderma do eliminacji form przetrwalnych grzybów patogenicznych w glebie. Do tej pory pod kątem zdolności do pasożytowania przetrwalników przebadano ok. 60 izolatów Trichoderma.
Fot. 4. Przerastanie sklerocjów S. sclerotiorum przez Trichoderma. A- kontrola, B – sklerocja odzyskane z gleby zmieszanej z zarodnikami konidialnymi Trichoderma.
Zdolności Trichoderma do indukcji odporności w roślinach testowych.
W celu sprawdzenia możliwości wykorzystania Trichoderma do indukowania reakcji odpornościowych w roślinach wykonano dwuetapowe testy. W pierwszym etapie wykonano szereg doświadczeń w komorze wegetacyjnej. Nasiona ogórka Iwa F1 oraz pomidora Remiz F1 wysiewano do wielodoniczek wypełnionych sterylizowaną ziemią zmieszaną z zawiesinami zarodników konidialnych różnych szczepów Trichoderma. Po czterech tygodniach wzrostu z roślin testowych odcinano drugi rozwinięty liść licząc od góry. Odcięte liście inokulowano grzybnią lub zarodnikami grzyba Botrytis cinerea i utrzymywano w wilgoci, w temperaturze 25 oC przez 7 dni. Po tym czasie mierzono średnice nekrotycznych plam na liściach, powstałych w wyniku rozwoju zaszczepionego grzyba B. cinerea (fot. 5).
Fot. 5. Przykład wstępnego doświadczenia na zdolność Trichoderma do indukcji odporności w roślinach testowych. A – liście rośliny kontrolnej rosnącej w wysterylizowanej ziemi, B – liście rośliny traktowanej aktywnym izolatem Trichoderma.
Na podstawie tego testu stwierdzono, że tylko nieliczne izolaty Trichoderma dodawane do gleby, miały wpływ na ograniczanie rozwoju nekroz na liściach inokulowanych roślin. Aby jednak potwierdzić zdolność Trichoderma do wzbudzania odporności w roślinach, przeprowadzono bardziej szczegółowe badania aktywności enzymów wskazujących na indukcję odporności w roślinach. Analizy te wykonano w Katedrze Fizjologii i Biochemii Roślin Uniwersytetu Łódzkiego. Materiał do badań stanowiły roślinny ogórka Iwa F1 rosnące w 0.5 l doniczkach wypełnionych sterylizowaną ziemią inokulowaną zarodnikami konidialnymi grzybów Trichoderma w dawce 1 x 106/ g ziemi. Dotychczas w doświadczeniach zastosowano 12 izolatów Trichoderma hamujących rozwój nekroz na liściach, działających stymulująco na wzrost roślin ogórka lub wykazujących antagonistyczne właściwości wobec grzybów patogenicznych. Połowę roślin w poszczególnych wariantach zaszczepiono grzybnią R. solani 7 dni przed zakończeniem eksperymentu. Rośliny utrzymywano w komorze wzrostowej do fazy 5 liścia właściwego (4 tygodnie). W tak przygotowanym materiale roślinnym oznaczano stężenie nadtlenku wodoru (H2O2), aktywność enzymów zaangażowanych w metabolizm reaktywnych form tlenu: peroksydazy askorbinianowej (APX) i katalazy (CAT) oraz stopień utleniania lipidów błonowych na podstawie stężenia nadtlenków lipidowych (TBARS).
Wyniki tych analiz wykazały, że inokulacja ogórków grzybnią R. solani powodowała niewielki wzrost stężenia nadtlenku wodoru w tkankach tych roślin. Obecność zaś zarodników konidialnych niektórych szczepów Trichoderma w podłożu powodowała bardziej wyraźny wzrost stężenia H2O2. Zwiększona synteza reaktywnych form tlenu, w tym nadtlenku wodoru, jest jedną z pierwszych reakcji obronnych komórek roślinnych w odpowiedzi na kontakt z mikroorganizmami. Ochronne działanie H2O2 w komórkach roślinnych może być bezpośrednio związane z jego toksycznym działaniem na kiełkowanie zarodników i wzrost grzybni patogenów lub pośrednio może współdziałać w procesach lignifikacji ścian komórkowych.
W roślinach ogórka traktowanych Trichoderma, w których stwierdzono wzrost stężenia H2O2 obserwowano również tendencję do obniżenia aktywności peroksydazy askorbinianowej i katalazy, enzymów, którym przypisuje się kluczową rolę w usuwaniu nadtlenku wodoru z komórek roślinnych. Ponadto w roślinach ogórka traktowanych R. solani i Trichoderma obserwowano znacznie niższe stężenie nadtlenków lipidowych niż w roślinach kontrolnych inokulowanych R. solani. Świadczy to o mniejszym stopniu uszkodzenia błon komórkowych w tych roślinach w wyniku porażenia przez patogena. Wyniki te mogą sugerować, że obecność niektórych szczepów Trichoderma w podłożach sprzyja uaktywnianiu naturalnych mechanizmów obronnych roślin.
Wpływ Trichoderma na wschody oraz rozwój korzeni i biomasę roślin
Aby sprawdzić oddziaływanie testowanych izolatów Trichoderma na rozwój roślin warzywnych, przeprowadzono szereg biotestów w kontrolowanych warunkach komory klimatycznej z roślinami ogórka Iwa F1 oraz pomidora Remiz F1. Tak jak w poprzednio opisanych testach, nasiona ogórka lub pomidora wysiewano do podłoża zmieszanego z zarodnikami badanych szczepów Trichoderma. Po miesiącu wzrostu odcinano części nadziemne roślin i mierzono ich wysokość oraz świeżą masę części nadziemnych, a także suchą masę korzeni po ich wypłukaniu. Część korzeni przeznaczono do badania zdolności zastosowanych szczepów Trichoderma do kolonizacji strefy korzeniowej roślin. W tym celu odkażone powierzchniowo fragmenty korzeni wykładano na szalki z pożywką zawierającą antybiotyki hamujące rozwój bakterii. Po tygodniu inkubacji obserwowano oraz oznaczano grzyby wyrosłe z fragmentów korzeni. Spośród kilkudziesięciu przebadanych do tej pory izolatów Trichoderma jedynie nieliczne wykazywały tendencje do aktywnej kolonizacji epidermy korzeni ogórka i pomidora. Prawdopodobnie celowym jest również sprawdzenie wielkości populacji stosowanych szczepów Trichoderma w ziemi bezpośrednio przylegającej do korzeni roślin.
Fot. 6. Przygotowania do doświadczeń dotyczących wpływu Trichoderma na rozwój roślin.
W trakcie badań stwierdzono, że niektóre izolaty Trichoderma miały pozytywny wpływ na rozwój biomasy roślin testowych. Niektóre szczepy jednak wyraźnie hamowały wzrost młodych roślin w porównaniu z roślinami kontrolnymi. Jedną z przyczyn takiego zjawiska mogła być zbyt wysoka dawka zarodników stosowana na 1 g gleby – 108. W kolejnych doświadczeniach dawkę tą zmniejszono do 106 zarodników na 1 g gleby. Konieczne są dalsze badania w kierunku określenia optymalnej dla roślin oraz skutecznej dla ich ochrony dawki inokulum.
3. Realizacja zadania badawczego ZB4 pt. „Odporność izolatów Trichoderma na fungicydy najczęściej stosowane w integrowanej uprawie warzyw ”
Celem tego zadania jest sprawdzenie wrażliwości badanych izolatów Trichoderma na najczęściej używane w ochronie warzyw substancje czynne fungicydów. Selekcja szczepów pod tym kątem umożliwi stosowanie tych grzybów w uprawach naprzemiennie lub z obniżonymi dawkami fungicydów, co może mieć wpływ na podniesienie efektywności zabiegów ochronnych. W testach laboratoryjnych jako dodatki do pożywek hodowlanych stosowano Amistar 250 SC (azoksystrobina) w stężeniach 0, 0.1 i 0.5%; Dithane NeoTec 75 WG (mankozeb) w stężeniach: 0, 0.15 i 0.3%; Bravo 500 SC (chlorotalonil) w stężeniach: 0, 0.15 i 0.3%; Topisn M 500 SC (tiofanat metylu) w stężeniach: 0, 0.1 i 0.2%; Previcur Energy 840 SL (propamokarb+fosetyl glinu) w stężeniach: 0, 0.15 i 0.75%. Na szalki zawierające pożywkę glukozowo-ziemniaczana z dodatkami fungicydów wszczepiano poszczególne izolaty Trichoderma i po 4 dniach inkubacji mierzono średnicę kolonii grzybów w odniesieniu do kolonii kontrolnych nie poddanych działaniu fungicydów.
Stwierdzono, że szczepy Trichoderma różniły się wrażliwością na zastosowane fungicydy. Najsilniej wzrost Trichoderma hamował mankozeb, chlorotalonil i tiofanat metylu. Grzyby były znacznie mniej wrażliwe na działanie azoksystrobiny w preparacie Amistar 250 SC i propamokarbu z fosetylem glinu stosowanego preparacie Previcur. Niektóre z izolatów wykazywały zdolność do wzrostu nawet po zastosowaniu wyższych dawek badanych preparatów (fot. 7), co wskazuje na możliwość ich stosowania naprzemiennie z konwencjonalnymi środkami ochrony roślin. Może to stanowić jedną z dróg do ograniczenia zużycia chemicznych środków w uprawie warzyw.
Fot. 7. Wzrost Trichoderma na pożywce z dodatkiem preparatu Previcur Energy 840 SL.
4. Realizacja zadania badawczego ZB5 pt. „Wybór materiałów odpadowych i produkcja biomasy grzybów Trichoderma”.
Celem tego zadania jest wybór odpowiedniego materiału organicznego, który będzie służył do intensywnego namnażania wybranych w testach AMOR aktywnych szczepów Trichoderma, a jednocześnie będzie mógł być stosowany jako dodatek organiczny do gleby, pozytywnie wpływający na jej strukturę i stan odżywienia roślin. Materiały do tego zadania są wybierane spośród organicznych substratów odpadowych, których utylizacja stanowi problem dla gospodarstw rolniczych lub przedsiębiorstw przemysłu rolno-spożywczego. W pierwszym półroczu 2010 r. oceniano wzrost i intensywność zarodnikowania pięciu izolatów Trichoderma wstępnie wyselekcjonowanych jako obiecujące w testach AMOR. Testowano wzrost tych izolatów na kilkudziesięciu podłożach organicznych stanowiących mieszanki takich składników organicznych jak m.in.: słoma pszenna, jęczmienna, słoma z pszenżyta, podłoże odpadowe z produkcji pieczarek, zmielona tektura z dodatkiem wytłoczyn z rzepaku, otrąb, sacharozy, skrobi, odpadów pochodzących z produkcji przetworów warzywnych oraz gospodarstwa domowego (np. obierki ziemniaczane, łuski cebuli, liście kapusty), odpadowej pożywki płynnej z uprawy bezglebowej warzyw. Z powyższych materiałów przygotowywano kompozycje o różnej procentowej zawartości składników, które zaszczepiano grzybnią badanych izolatów Trichoderma w szalkach Petriego. W trakcie inkubacji w temperaturze 25 oC obserwowano tempo wzrostu grzybni i zarodnikowania poszczególnych izolatów na różnych podłożach (fot. 8).
Fot. 8. Pomiary grzybni i zarodnikowania na różnych podłożach z odpadów organicznych.
Wykonano także analizy chemiczne i fizyczne materiałów organicznych oraz ich mieszanek. Analizy prowadzono dwoma metodami: ekstrakcja makroskładników (N, P, K, Ca, Mg) w 2% kwasie octowym; mineralizacja w stężonym kwasie azotowym w układzie zamkniętym i mineralizacja w stężonym kwasie siarkowym dla oznaczania zawartości ogólnych azotu. Analizowane składniki mineralne oznaczano metodami spektrometrii plazmowej, absorpcji atomowej oraz metodami kolorymetrycznymi zgodnie z procedurami wg norm PN-EN1339, PN-EN1340 i PN-EN1341. Jako cechy fizyczne materiałów badano: suchą masę, zawartość substancji organicznej, zawartość popiołu, węgiel ogólny, gęstość objętościową, kurczliwość, gęstość części stałych, porowatość ogólną, pojemność wodną, pojemność powietrzną.
Stwierdzono, że wzrost Trichoderma na „czystych” materiałach organicznych – bez dodatków np. na słomie, podłożu popieczarkowym, tekturze był bardzo słaby lub grzyby nie rozwijały się wcale. Dopiero wzbogacenie tych materiałów dodatkami takimi jak odpady warzywne lub moczenie w pożywce z uprawy bezglebowej w znacznym stopniu poprawiało wzrost i zarodnikowanie grzybów. Okazało się, że słoma jęczmienna nie nadaje się na składnik podłoża dla Trichoderma, ponieważ hamowała wzrost tych grzybów. Podobnie grzyby Trichoderma źle reagowały na dodatek liści kapusty. Natomiast bardzo dobrze rosły i zarodnikowały w podłożach ze słomy pszennej z dodatkiem wytłoczyn z marchwi, buraka oraz łusek z cebuli moczonych w pożywce odpadowej z upraw bezglebowych. Obserwowano również różnice we wzroście na stosowanych podłożach między poszczególnymi izolatami Trichoderma (fot. 9). Na badanych podłożach najlepiej zarodnikowały szczepy SKB1 (T. harzianum) oraz 29.05.3C (T. atroviride). Planowane jest testowanie intensywności wzrostu kolejnych izolatów Trichoderma wyselekcjonowanych za pomocą systemu AMOR.
Już w tej chwili na podstawie przeprowadzonych badań można wyłonić kilka kompozycji podłoży korzystnych dla produkcji biomasy Trichoderma w celu ich dalszych badań nad technologią produkcji większych objętości tego materiału do zastosowania w warunkach polowych.
Fot. 9. Różna intensywność wzrostu i zarodnikowania Trichoderma w zależności od rodzaju podłoża.
5. Realizacja zadania badawczego ZB10 pt. „Monitoring Trichoderma w środowisku glebowym”
Celem zadania ZB10 jest ocena przeżywalności zastosowanych grzybów Trichoderma w glebie. Ważne jest, aby sprawdzić jak długo i na jakim poziomie ilościowym użyte szczepy Trichoderma będą utrzymywały się w nowym środowisku. Szczególnie interesujące jest jak będą zachowywały się szczepy aktywnych grzybów zastosowane w formie mieszanki kilku izolatów. Planowane jest prowadzenie tych badań za pomocą metod molekularnych ze względu na to, iż w glebie polowej zazwyczaj występują różne gatunki grzybów z rodzaju Trichoderma, które trudno byłoby odróżnić od nowo wprowadzonych szczepów za pomocą tradycyjnych metod izolacji.
W pierwszej kolejności zaplanowano analizę zróżnicowania genetycznego kolekcji izolatów Trichoderma wybranych do badań w projekcie. W związku z tym wykonywane są analizy profili genetycznych przy użyciu losowych starterów ERIC-PCR.
Wypróbowano kilka metod hodowli grzybni w celu uzyskania materiału do efektywnej izolacji DNA. Prowadzono optymalizację izolacji DNA z Trichoderma z zastosowaniem różnych metod m.in.: metodą solną wg Aljabi’ego, za pomocą zestawu DNeasy Plant Mini Kit (Qiagen), Genomic Mini (A&A Biotech), NucleoSpin Tissue i NucleoSpin Plant II (Machery-Nagel) oraz metodą CTAB wg Aldrich i Cullis. Na podstawie szeregu testów wybrano i zmodyfikowano najlepszą metodę izolacji dla badanych szczepów. Ustalono też, iż grzybnia uzyskana w kulturze płynnej z wytrząsaniem jest bardziej odpowiednia do badań niż uzyskana z kultury statycznej lub wyprodukowana na pożywce agarowej. Efektywność ucierania grzybni w ciekłym azocie poprawia dodatek piasku kwarcowego.
Uzyskane sekwencje DNA dla 6 typów produktów PCR otrzymanych dla trzech reprezentatywnych izolatów Trichoderma z gatunków T. harzianum, T. atroviride, T. virens z wykorzystaniem 6 par starterów taksonomicznych. Odczyty uzyskane w wyniku sekwencjonowania wyedytowano i złożono w kontigi, a następnie porównano z sekwencjami dostępnymi w bazie Trich O’Key oraz NCBI.
Fot. 10. Izolacja DNA z grzybni wybranych szczepów Trichoderma.
6. Działania promocyjne w pierwszym półroczu 2010 r.
W trakcie realizacji projektu w pierwszym półroczu 2010 r. prowadzono intensywną działalność promocyjną. W styczniu zorganizowano dwudniową konferencje inauguracyjną pt. „Polskie szczepy Trichoderma w ochronie roślin i zagospodarowaniu odpadów organicznych”. W konferencji uczestniczyło ponad 100 osób. Prezentowane były wykłady na temat planowanej realizacji projektu, a także dotyczące znaczenia grzybów Trichoderma w ochronie roślin i gospodarce. Przedstawiony został również referat o możliwościach i problemach z zagospodarowaniem odpadów organicznych. Na konferencji obecni byli przedstawiciele mediów, udzielono m.in. wywiadów dla stacji radiowych, ukazały się też notatki dt. konferencji w prasie lokalnej. Opublikowano również artykuły w czasopismach takich jak Owoce, Warzywa, Kwiaty oraz Hasło Ogrodnicze. Od początku roku uruchomiono stronę internetową projektu, na której zamieszczane są wszelkie informacje związane z realizacją oraz promocją projektu. W lutym został również wygłoszony referat na temat projektu w ramach cyklu seminaryjnego Instytutu Warzywnictwa, a także w czasie Targów Poznańskich – Salon Kontraktacji Ogrodniczych ProHorti, gdzie przygotowano także stoisko reklamowe.
Fot. 11. Działalność promocyjna w projekcie.
W drugim kwartale ukazały się kolejne publikacje dt. projektu w Wiadomościach Rolniczych (nr 4, „Chronić a nie szkodzić”), oraz Informatorze Instruktora wydanym przez Polski Zwiazek Działkowców („Biopreparaty na bazie Trichoderma – to szansa także dla działkowców”). Projekt był promowany podczas Targów Turystyki Wiejskiej i Agroturystyki AGROTRAVEL w Kielcach, podczas konferencji naukowej w Instytucie Sadownictwa i Kwiaciarstwa w Skierniewicach, a także podczas Konferencji Szkoleniowej dla Instruktorów Krajowych i Okręgowych w Częstochowie. W czasie wyjazdów terenowych promowano projekt wśród rolników ekologicznych. Przeprowadzono również rozmowy ze studentami szkół wyższych zachęcając ich do czynnego udziału w projekcie. Do tej pory w zadaniach ZB3 i ZB5 zatrudniono trzech studentów.
| |||||||||||||||||||||||